.png)
關鍵字
混和有機溶劑、剪切黏度、離子遷移速度、溫度響應實驗、活化能
目標
鋰離子電解質溶液通常由環狀和線性碳酸鹽組成,其黏度和介電常數會影響離子遷移和電池在各種溫度下的性能,因此我們可以透過了解混合物組成和溫度變化如何影響電解質溶液的剪切黏度來對電池性能進行評估。 在這份應用文章中,我們使用VROC® initium one plus 進行了多個電解質溶液的溫度響應實驗,其中包括乙烯碳酸酯、二甲碳酸酯和乙基甲基碳酸酯,此外,我們還將阿紐士方程式(Arrhenius equation)擬合到對應溫度的黏度結果上,以計算電解液的活化能數值。
背景知識:電解質溶液通常由環狀碳酸酯如乙烯碳酸酯(EC)和線性碳酸酯如二甲碳酸酯(DMC)或乙基甲基碳酸酯(EMC)的組成,碳酸鹽充當溶劑,用作鋰離子在正極和負極之間遷移的介質,鋰離子電池的性能取決於溶劑的介電常數和黏度,儘管具有較高介電常數的溶劑,例如EC,更容易將鋰鹽解離成其組成離子,但其較高的黏度會導致較低的離子遷移率μ,如所下示的方程式。

其中η代表黏度,r的值對應到離子的半徑,因此,優化環狀和線性碳酸酯的濃度以實現在相關溫度範圍內具有理想黏度和性能的電解液非常重要,我們應該了解電解液成分的混合比例和溫度會如何影響用電解液的應用。 在本篇文章中,我們探討了具有不同DMC、EMC和EC比例的電解液黏度,並將其和溫度變化串聯作圖,此外,我們根據黏度與溫度的結果,計算EC對DMC和EMC比例的活化能。
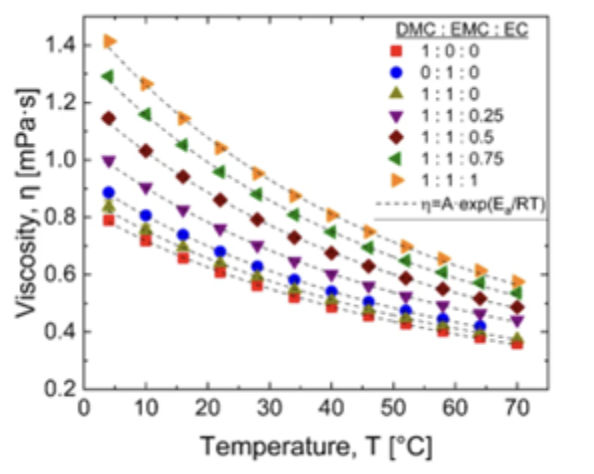
圖一、對於含有不同比例的DMC、EMC和EC的電解質,將穩態(steady-state)剪切黏度作為溫度的函數
實驗
本次實驗準備了包含二甲碳酸酯(DMC)、乙基甲基碳酸酯(EMC)和乙烯碳酸酯(EC)的電解液混合物,其比例分別為: 1:0:0 0:1:0 1:1:0 1:1:0.25 1:1:0.5 1:1:0.75 1:1:1 上述溶劑(DMC、EMC和EC)均購自Sigma Aldrich,本次實驗使用VROC® initium one plus,使用A05晶片(流道寬度=50mm,Pmax = 12kPa),每次實驗載入了約70μL的樣品,在溫度範圍T = 4 ~70°C內測量了數十個溫度下的電解液黏度,並且所有實驗運行,均使用了自動測試模式,軟體會調整流速以提供壓力讀數達到極限可承受壓力的50%。
測試結果
上圖一顯示了七個樣品的剪切黏度隨溫度變化的圖表,這些樣品包含不同比例的DMC、EMC和EC,每個樣品對應溫度的黏度值都是多次實驗的平均值,所有樣品的黏度隨著溫度的升高而下降,例如,DMC的黏度隨著溫度從T = 4°C上升到T = 70°C,從η約0.8下降到η約0.35 mPa·s,而添加EC到混合物中會增加黏度,此外,較大黏度的混合物表現出較陡的黏度隨溫度變化的下降。圖一中的虛線是對每個混合物的黏度與絕對溫度值的阿紐士擬合,擬合方程給出了黏度η對絕對溫度T的依賴性,如下所示: rate = Ae-Ea/RT 在這個方程中,A是指數前因子,Ea是活化能,R是氣體常數,對數據的擬合說明,阿紐士模型適用於所研究的DMC / EMC / EC混合物的溫度範圍,並可用於在與電池應用相關的溫度下內插或外插黏度值,從每個阿紐士擬合中可以提取活化能,並將其作為EC對DMC和EMC比例的函數繪製在下圖二中。
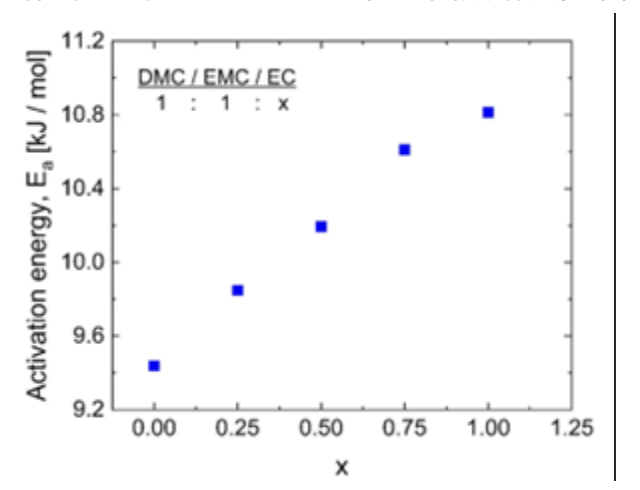
圖二、從圖一所示的阿紐士擬合中獲得的活化能,作為EC對DMC和EMC比例的函數。
當EC的比例從0增加到1,包含DMC和EMC的混合物中的活化能從Ea約9.4增加到Ea約10.8kJ/mol,活化能反映了分子的動力學,活化能的增加可反映出隨著黏度和EC濃度的增加,溶劑分子的運動能力減小。
結論
電解液的黏度對鋰離子電池的性能起著重要作用,其溫度增加將會導致黏度下降,此外,隨著電解液混和物中EC對DMC和EMC的比例越高,將導致電解液具有越高的黏度,我們甚至可以透過使用阿紐士擬合公式推算活化能。 本篇文章展示了使用VROC® initium one plus在與電池應用相關的廣泛溫度範圍內測量電解液的黏度(η約1 mPa·s)準確性和可靠性。
參考資料
Dharmaraj, V. L., Godfrin, P. D., Liu, Y., & Hudson, S. D. (2016). Rheology of clustering protein solutions. Biomicrofluidics, 10(4), 043509.
