
4. 水活性在藥物的深度應用:
4-1. 非晶型賦形劑的關鍵水活性(CRITICAL WATER ACTIVITY FOR AMORPHOUS EXCIPIENTS)
非晶賦形劑通常是低水分的,並處於一種亞穩定(meta-stable)的玻璃狀態(glassy-state),它們對API的保護能力取決於它們在產品的整個生命周期中保持在這個狀態的時間,如若賦形劑基質從玻璃狀態轉變為橡膠狀態,稱為“玻璃轉變(glass transition)”,將導致結構崩潰、溶解性變化以及易結塊(caking)和結晶的增加(4),因此,產品將無法順暢流動、壓縮或製成片劑,並且可能提前發生溶解。
玻璃轉變可能通過溫度變化或水活性變化引起,產品發生玻璃轉變的水活性被稱為“臨界水活性”,可以通過濕氣吸附等溫線中的急劇拐點來識別(參見下圖二)(5),為了保持非晶賦形劑的功能性,重要的是確定其臨界水活性並採取措施確保產品的水活性在整個產品的生命周期中保持在該臨界水活性以下。
4-2. 水活性與微生物孳生問題
要使水進入微生物需要水具備足夠的能量,這種水對於維持漲壓和正常的新陳代謝活動至關重要,而環繞微生物的水能量可以由水活性描述,為了使水進入微生物體內,該生物體的內部水活性必須低於其周圍環境的水活性,換句話說,水活性不是微生物生長所需的水量,它是水的能量,並且確定水是否能夠進入或離開細胞。
當微生物遇到水活性低於其內部水活性的環境時,它會經歷滲透應激,水離開細胞,從而降低漲壓並使自身代謝活動停止(參見下圖三),作為回應,生物體將嘗試通過濃縮溶質來控制其內部水活性,降低內部水活性的能力對每個生物體是不同的,這就是為什麼不同的微生物具有不同水活性最小生長限制的原因(參見下表一)(7)。
值得一提的是濕度含量並未被提及對微生物生長產生影響,因為影響生長的不是水的量,而是水活性(能量)與生物體的內部水活性,因此,為了控制微生物污染風險並伴隨減少微生物限度測試的任何努力,均必須基於水活性測量而不是濕度含量。
.png)
圖三、微生物在不同水活性環境下的行為
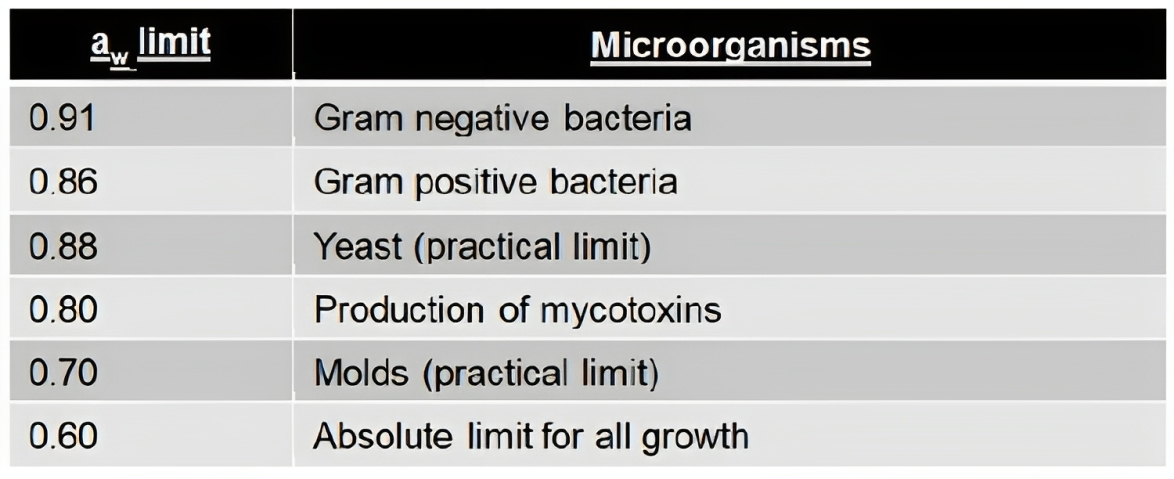
表一、不同微生物生長所需的最低水活性水平
4-3. 水活性與藥物活性成分降解的關係
呈上議題延伸,固體劑型藥品的水活性通常會低於0.70,這表明微生物生長不太可能發生,然而,處於這個範圍內的產品並不等於具有無限的產品壽命,對於水活性0.40-0.70範圍內的產品,API的化學降解是縮短產品壽命的主要原因,因為在此水活性下,藥物的反應速率達到最大,前面有提到一般來說隨著水活性的增加,反應速率也會增加(8),而可能導致API降解的最常見反應是水解,盡管脂質氧化(變質)和酶反應也可能在藥物活性成分損失中發揮作用,但主因還是水解,因此可以說為了防止這些水解反應導致API的重大損失最有效方法之一就是是將它們處理到低水活性,以使反應最小化,然後選擇適當的賦形劑,以最好地維持該水活性。
4-4. 追蹤藥物不同成分中的含水量變化
如下方濕氣吸附等溫線所示,水活性的增加伴隨著後續含水量的增加;然而,這種關係是非線性的,對每個產品都是不同的,而等溫線斜率的增加表示吸濕性增加,這將限制水活性的變化,因為濕氣被吸收,這通常是賦形劑中的一種理想特性,因為它允許產品在吸收濕氣的同時仍然保持API的水活性在限制降解反應速率的水平,簡單來說就是賦形劑擋在API前吸收了水。
API的水活性增加到不安全水平的另一種方式是通過多成分制藥品(如膠囊)中的濕氣遷移(moisture migration),如果各組分的水活性不同,則水將在各組分之間移動,而與它們的濕氣含量無關,因為水是從高水活性(能量)移動到低水活性(9),濕氣將在組分之間持續移動,直到達到平衡水活性,這會由每個組分的濕氣吸附等溫線所決定(參見下圖4),所以如果API的水活性增加,可能會加速其降解,為了避免這個問題,必須設計各組分具有相同的水活性。
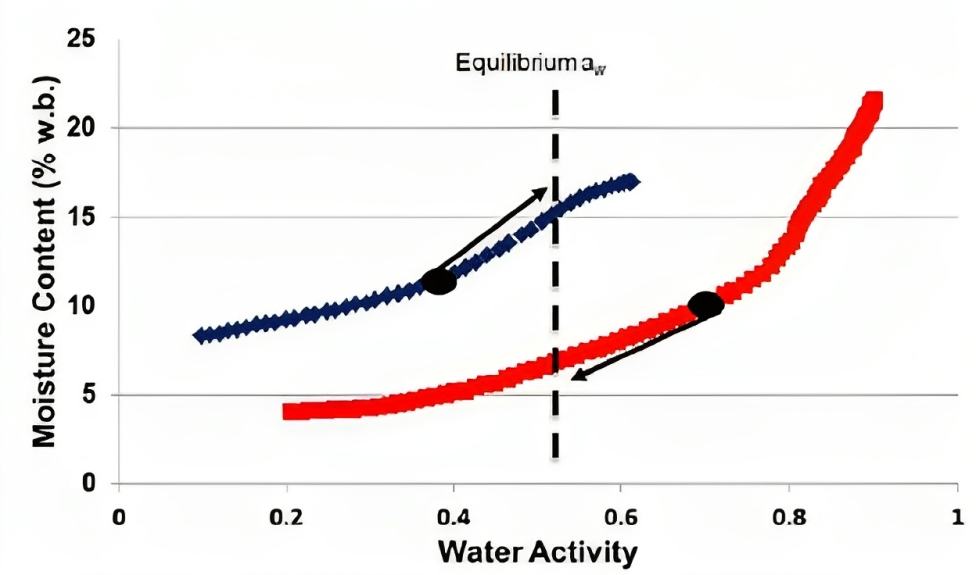
圖四、兩個藥物組分的濕氣吸附等溫線,黑點表示兩者的初始水活性,而箭頭表示每個組分的水運動方向及伴隨的濕氣含量變化,虛線垂直線表示組分將達到平衡並停止濕氣運動的水活性,等溫線曲線穿越虛線垂直線的點表示每個組分在最終水活性下的濕氣含量(9)
5. 結論
水活性有時在製藥品質控管和配方中容易被忽視和低估,然而,它提供了優化產品穩定性的關鍵信息,透過確定產品的理想水活性範圍並將水活性測量納入例行參數進行控管,可以解決潮解、結塊、凝聚、溶解、微生物易感性、API降解等問題,在這個理想範圍內的水活性下,大多數藥物產品可以確保無微生物孳生問題,從而節省時間並降低生產成本。
6. 參考資料:
- Fontana, A.J and Carter, B.P. 2020. Measurement of Water Activity, Moisture Sorption Isotherm, and Moisture Content of Foods. In Water Activity in Foods: Fundamentals and Applications, 2nd Edition. Wiley-Blackwell.
- Lipasek, R.A., Ortiz, J.C., Taylor, L.S., & Mauer, L.J. 2012. Effects of anticaking agents and storage conditions on the moisture sorption, caking, and flowability of deliquescent ingredients. Food Research International, 45(1), 369–380.
- Carter, B.P. 2020. Applications for Dynamic Moisture Sorption Profiles in Foods. In Water Activity in Foods: Fundamentals and Applications, 2nd Edition. Wiley-Blackwell.
- Roos, Y.H. 2020. Water Activity and Glass Transition. In Water Activity in Foods: Fundamentals and Applications, 2nd Edition. Wiley-Blackwell.
- Carter, B.P. and S.J. Schmidt. 2012. Developments in glass transition determination in foods using moisture sorption isotherms. Food Chemistry 132:1693-1698.
- Potts, M. 1994. Desiccation tolerance of prokaryotes. Microbiological Reviews 58:755-805.
- Beuchat, L.R. 1983. Influence of water activity on growth, metabolic activities, and survival of yeasts and molds. J. Food Prot. 46:135.
- Bell, L.N. 2020. Moisture Effects on Food’s Chemical Stability. In Water Activity in Foods: Fundamentals and Applications, 2nd Edition. Wiley-Blackwell.
- Bell, L.N. and Labuza, T.P. 2000. Moisture sorption: practical aspects of isotherm measurement and use (Vol. Second). St. Paul, MN: American Association of Cereal Chemists.
