使用FDA染色評估細胞活力(Cell Viability)
背景:判定藻類細胞的死亡與否對於許多應用來說皆是重要的,包含: 廢水分析、除藻劑測試、中宇宙實驗(mesocosm experiments)及壓艙水監控(ballast water monitoring)。細胞活力染色(viability staining)是很常在流式細胞儀中使用,用來判定樣品中活細胞及死細胞的群落分布。
FlowCam8400搭載著雷射、數位鏡頭,雙通道螢光檢測系統,可用於許多染劑用以評估細胞的活性,在本篇文章中,我們將使用搭載488nm藍光雷射的FlowCam8400去觀察FDA染色的樣品。
針對FDA,讓我們在做個簡單的概述,其實FDA本身並不是一個螢光分子,然而當一水相樣品中的細胞帶著具活性的水解酶和FDA接觸時,FDA將轉換為大家耳熟能詳的綠螢光分子,也就是FITC。所以當我們進行實驗時,若細胞是具有活力且有完好的細胞膜結構,在FlowCam8400的trigger模式(雷射激發)下,它將產生充足的綠光螢光訊號,反之死細胞則只會產生相對於活細胞較微弱甚至無的綠光螢光訊號。
樣品準備:
本次實驗共使用兩種來源的樣品: 1. 人工養殖的綠藻Staurastrum 2. 從池塘獲取的天然樣品,而關於FDA染色的流程,首先我們使用25 μL的FDA溶液(5 mg/ml)以10 mL的二次水稀釋並保存於4°C,接著將人工樣品及池塘樣品過70μm的濾片,確保在後續實驗過程將不會引起堵塞問題。
接下來,我們分別準備人工養殖樣品2組和天然池塘樣品2組,之所以要同一樣品分為兩組是為了分別去分析死細胞和活細胞,死細胞的組別將在染色後放入溫度在70-90°C的水浴槽30分鐘,在所有的樣品皆準備好後,我們使用FDA稀釋液進行染色(250μL細胞樣品加入1mLFDA稀釋液),在室溫暗房中靜置10分鐘。
在靜置完畢後,每支樣品將使用FlowCam8400的Trigger模式進行實驗,本次的儀器配置為10倍物鏡、100μm微流道、1mL注射器及488nm的入射雷射。
實驗過程中,當細胞擁有足夠的chlorophyll或FDA將會”觸發”相機捕捉畫面,由於FlowCam8400在同一機台中擁有兩種螢光偵測器,便可以同時記錄chlorophyll色素訊號(以channel 1偵測大於650nm的螢光)和FDA訊號(以channel 2偵測範圍在510-540nm的螢光)
數據解析:
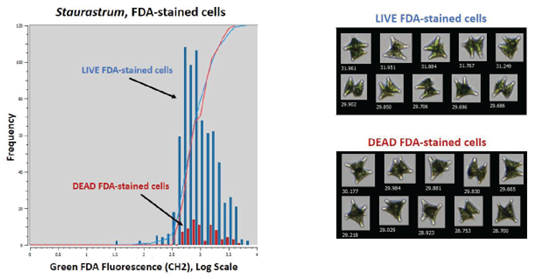
下圖一展示了人工養殖的綠藻Staurastrum的測試結果,可以發現死活細胞的FDA產生螢光訊號差異非常顯著。
下圖中的藍色柱狀圖為活細胞組別,紅色為死細胞組別,且我們可以從右側影像中發現若不透過Trigger模式觀察螢光訊號,將非常難以用細胞外觀資訊辨別細胞的死活。
下圖二則展示了天然池塘樣品的測試結果,和人工藻類樣品的測試結果類似,死活細胞組別也可以看出明顯的螢光訊號差異。
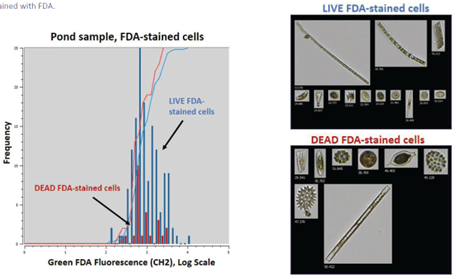
在一些應用中,FDA的沉澱物也將產生螢光訊號,我們在天然池塘樣品中就有觀察到這個情形(參見下圖三),而這些沉澱物將會在Trigger模式中被”誤認”為活細胞,此時FlowCam的影像就是十分有用的工具,我們可以透過影像辨別真的活細胞和沉澱物,藉此得到精準的活細胞數據。

結論:
本篇應用文章中揭示了FDA染色對於辨別細胞活的能力,不論是人工養殖的樣品或是天然樣品都可以使用,而這是得益於FlowCam8400的強大功能,藉由搭載488nm的入射雷射光可使用的Trigger模式進行螢光訊號分析。
除了本篇文章中介紹的FDA染劑,下列的色素或螢光染劑也可以透過FlowCam進行精確的分析:
- ThermoFisher LIVE DEAD® Fixable Green Dead Cell Stain Kit (488 nm Excitation)
- ThermoFisher LIVE DEAD® Fixable Red Dead Cell Stain Kit (633 nm Excitation)
- Sytox Green DEAD CELL Stain (488 nm Excitation)
- Neutral Red-Colormetric Vital Stain
- Methylene Blue-Colormetric Dead Stain (for Yeast viability analysis)

