本篇文章將講述對於微脂體或膠束樣品在不同的濃度環境下的粒徑測量。
脂質視乎其結構可溶解於極性或是非極性溶劑中,但通常來說它並不溶於水,而對於水的不溶性促使其可通過一些特殊的化學鍵合,根據這樣的特性便衍生出了許多特殊結構,像是血脂蛋白、細胞膜、膠束以及微脂體(可參見下方磷脂結構)。
生物性細胞膜:
生物組織由細胞組成,其內容物會進行生化反應,為生物體提供能量、組織修復、呼吸、免疫等,每個細胞內具有數個稱為胞器的不同功能單元,它們每一個都提供了特定的生物反應,而這些胞器被安置在一個叫做細胞膜的結構中(參見下圖一)其具有維持胞器保護的作用,並允許高度可控制化學反應的環境,提供所有物質進出的門。
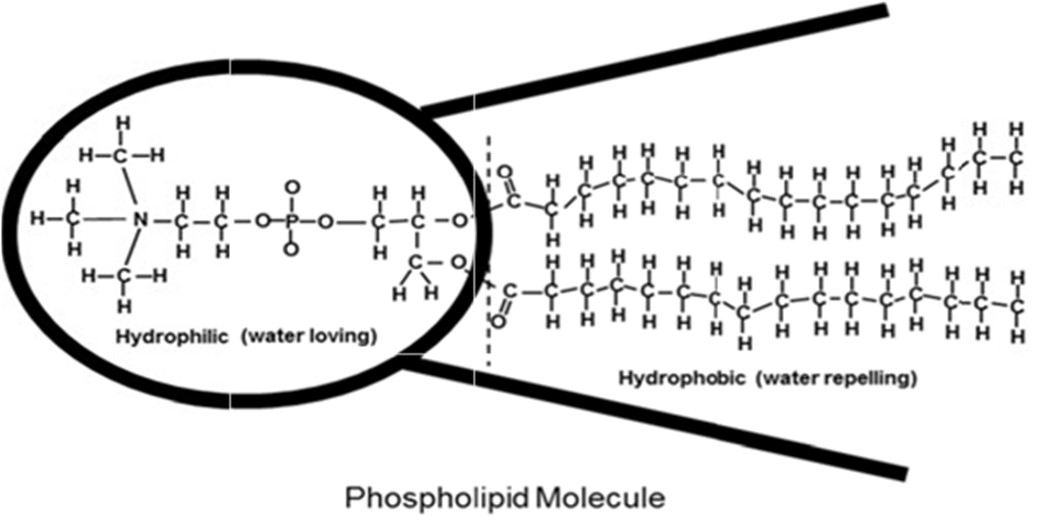
圖一、右側有尾巴結構的脂蛋白被有機(非極性)位點吸引,而左側被極性所吸引
脂質和蛋白質相互作用形成細胞膜和細胞的其他結構成分。全部化合物通過下圖所示的蛋白質-脂質複合物從而進入細胞(參見下圖二)。
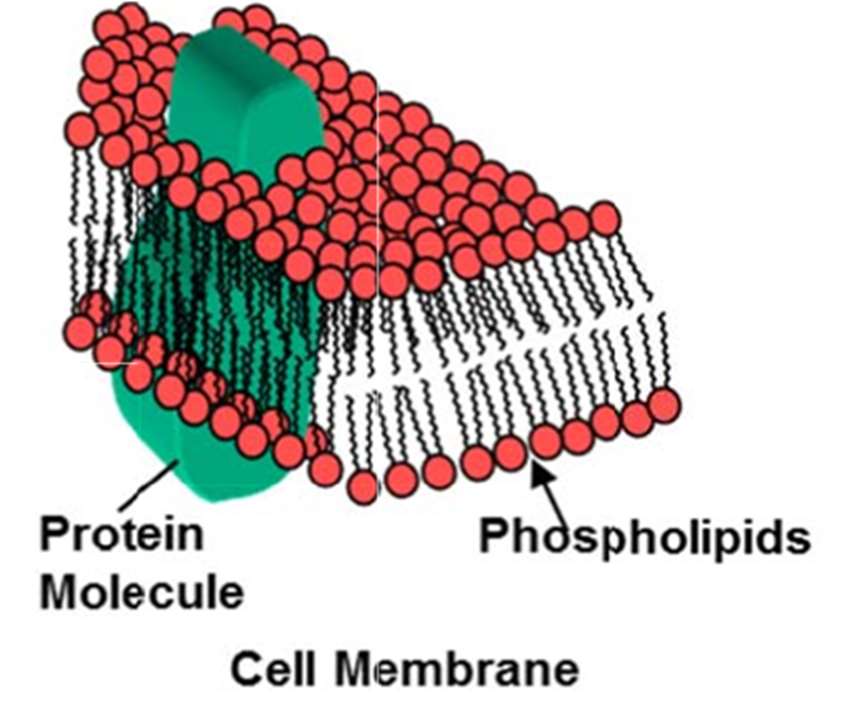
圖二、細胞膜磷脂構成了細胞膜,其尾端相互吸引,在此結構下蛋白質分子可以通過
脂質與膠束:
最早關於脂質與蛋白形成複合結構的研究是通過將特定的極性脂質(分子中含有親水部分)與水混合,這樣的脂質在水或極性有機溶劑(例如酒精)中可以顯示出些微的溶解度,而一種近年來主流用於製備脂質或膠束的脂質是磷脂酰膽鹼(phosphatidylcholine),其便可歸類為極性脂質,並且大多數的極性脂質在兩種類型的溶劑中都表現出分散性,這是因為它們具有兩親性(一種分子同時包含高非極性部分和高極性部分)性質。那這樣脂質與水混合會導致一兩相系統中—底部是水,頂部是油。接著如果使用強烈攪拌混合物超聲波探頭,可以使脂質與水形成混合物,在這種情況下小分子排列會以允許極性部分與水相互作用,而非極性部分定向遠離水的方式排列;將表面活性劑(表面活性劑)與水混和議會產生同樣的狀況,這是因為表面活性劑分子與磷脂相似,分子通常含有親水性(親水)和防水(疏水)部分。
當脂質以非常高的濃度與水混合時,脂質分子會排列形成離散的單位,稱為膠束(micelles),膠束具有與膜和微脂體相同的一般結構特徵。膠束可以使用磷脂製備,它們在結構內部不含水。使用這些結構可用於模擬復雜生物結構和原型藥物輸送系統的初步建模。
當脂質以非常高的濃度與水混合時,脂質分子會排列形成離散的單位,稱為膠束(micelles),膠束具有與膜和微脂體相同的一般結構特徵。膠束可以使用磷脂製備,它們在結構內部不含水。使用這些結構可用於模擬復雜生物結構和原型藥物輸送系統的初步建模。
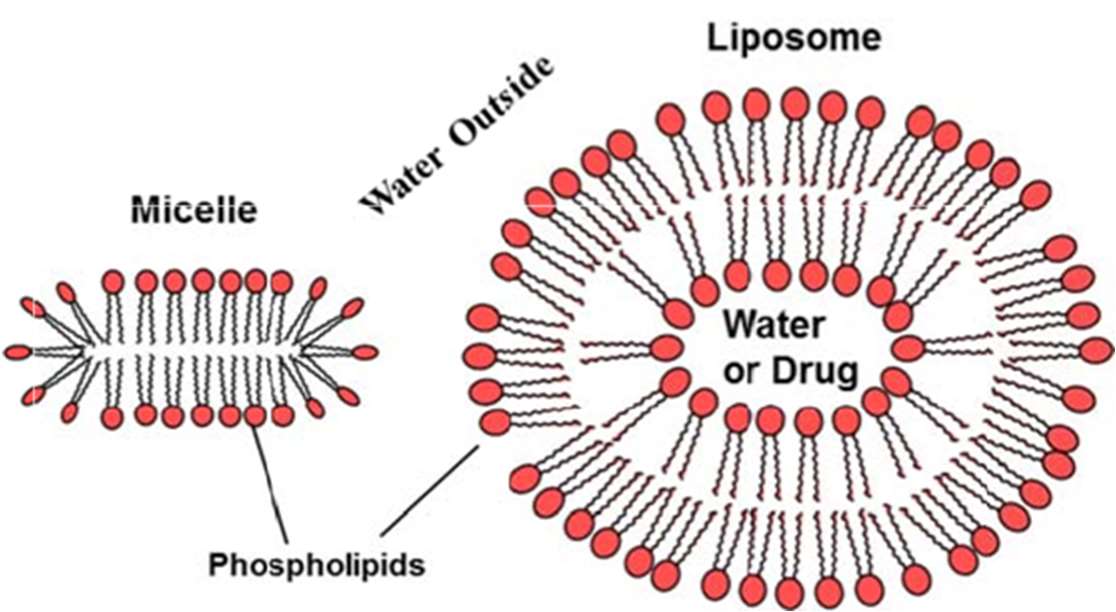
圖三、左邊為膠束,右邊為微脂體,兩者均由磷脂結構包圍
微脂體是通常使用脂質如磷脂酰膽鹼(如C-16)製備的結構,這些結構通常幾乎是球形的,與膠束一樣,分子的非極性尾部是熱力學驅動以在完成的結構內部定向,最終形成尺寸結構通常從 40 納米(透過皮膚給藥系統)到大幾微米(化妝品)。
標靶藥物與藥物傳輸系統:
對於製藥行業特別感興趣的是利用上述提到的概念開發具有標靶性質的藥物傳輸系統,根據不同的應用,膠束的脂質結構可以由多種極性脂質包括磷脂酰膽鹼和膽固醇來製備。在標靶藥物中,除了形成膠束外還涉及如何封裝藥物所需的步驟,這種結構後來稱為微脂體,由 Sessa 和 Weiss 在1970年代初期首次描述,因為它的化學性質膜,幾乎所有其他水溶性成分都不能滲透,且由於極性脂質和特別是磷脂可以帶正電或帶負電,微脂體可以以此改變其特性。具有由水-藥物隔開的多層結構微脂體已經應用於提供長時間釋放藥物的應用。在特定情況下,磷脂酰的極性部分(polar phosphatidyl portion)朝向微脂體的外部,這種結構類似於血細胞,注射後可以通過血液、腎臟和肝臟而不受損害並到達特定的生理部位,而不會過早釋放藥物導致潛在的副作用,通過這種方式,便可使用較低的藥物劑量達到藥效。更棒的是,內容物受到保護,不受胃腸道中可能會遇到各種酶、抑製劑和pH環境影響。
微脂體的穩定性:
為了保持微脂體的穩定性和保質期,製備時必須考慮幾個因素,例如溫度、壓力、微脂體組成份、藥物穩定性、離子強度和黏度,這些都可能具有穩定或不穩定的效果,而用於測量微脂體不穩定性的方式是粒徑測量。通常,微脂體必須小於 200 nm才能暢通無阻地通過血液系統,此外,這種大小的微脂體比較能使用200nm濾片進行過濾篩選以避免微生物汙染。
粒徑量測:
作為控制、修飾和穩定微脂體製備的直接結果,大小是一個關鍵測量參數。因此無論是多層結構的成形、微脂體團聚、膜破壞和微生物污染均可以通過以下方式進行研究粒徑的測量,這種測量的主要缺點是樣品可能需要稀釋、測量時間較長和儀器本身的偵測極限問題,而稀釋樣品的結果可能會導致數據的偏差,因為粒子間相互作用的改變或其穩定性被改變;層析法則是因為測量持續時間長,無法快速評估,且在測量中使用的化學品可能會產生結構尺寸的誤差。而雖然光子相關光譜法(PCS)儀器可用於縮短測量時間(5 至 30 分鐘)並測量極小顆粒(3 至 6000 nm),但在進行微脂體測量時還是需要稀釋。
標靶藥物與藥物傳輸系統:
對於製藥行業特別感興趣的是利用上述提到的概念開發具有標靶性質的藥物傳輸系統,根據不同的應用,膠束的脂質結構可以由多種極性脂質包括磷脂酰膽鹼和膽固醇來製備。在標靶藥物中,除了形成膠束外還涉及如何封裝藥物所需的步驟,這種結構後來稱為微脂體,由 Sessa 和 Weiss 在1970年代初期首次描述,因為它的化學性質膜,幾乎所有其他水溶性成分都不能滲透,且由於極性脂質和特別是磷脂可以帶正電或帶負電,微脂體可以以此改變其特性。具有由水-藥物隔開的多層結構微脂體已經應用於提供長時間釋放藥物的應用。在特定情況下,磷脂酰的極性部分(polar phosphatidyl portion)朝向微脂體的外部,這種結構類似於血細胞,注射後可以通過血液、腎臟和肝臟而不受損害並到達特定的生理部位,而不會過早釋放藥物導致潛在的副作用,通過這種方式,便可使用較低的藥物劑量達到藥效。更棒的是,內容物受到保護,不受胃腸道中可能會遇到各種酶、抑製劑和pH環境影響。
微脂體的穩定性:
為了保持微脂體的穩定性和保質期,製備時必須考慮幾個因素,例如溫度、壓力、微脂體組成份、藥物穩定性、離子強度和黏度,這些都可能具有穩定或不穩定的效果,而用於測量微脂體不穩定性的方式是粒徑測量。通常,微脂體必須小於 200 nm才能暢通無阻地通過血液系統,此外,這種大小的微脂體比較能使用200nm濾片進行過濾篩選以避免微生物汙染。
粒徑量測:
作為控制、修飾和穩定微脂體製備的直接結果,大小是一個關鍵測量參數。因此無論是多層結構的成形、微脂體團聚、膜破壞和微生物污染均可以通過以下方式進行研究粒徑的測量,這種測量的主要缺點是樣品可能需要稀釋、測量時間較長和儀器本身的偵測極限問題,而稀釋樣品的結果可能會導致數據的偏差,因為粒子間相互作用的改變或其穩定性被改變;層析法則是因為測量持續時間長,無法快速評估,且在測量中使用的化學品可能會產生結構尺寸的誤差。而雖然光子相關光譜法(PCS)儀器可用於縮短測量時間(5 至 30 分鐘)並測量極小顆粒(3 至 6000 nm),但在進行微脂體測量時還是需要稀釋。
.jpg)
圖四、以不同時長超聲波製備之微脂體
上圖中通過將3克磷酸化膽鹼(PC)與97克去離子水混合製備的三種尺寸的磷酸化膽鹼 (PC)微脂體,我們以不同時長超聲波探頭處理混和樣品30秒(藍色),2分鐘(紅色)和5分鐘(綠色)產生三種大小的脂質體,我們可以發現隨著處理時間的拉長,大顆粒的群落逐漸消失。
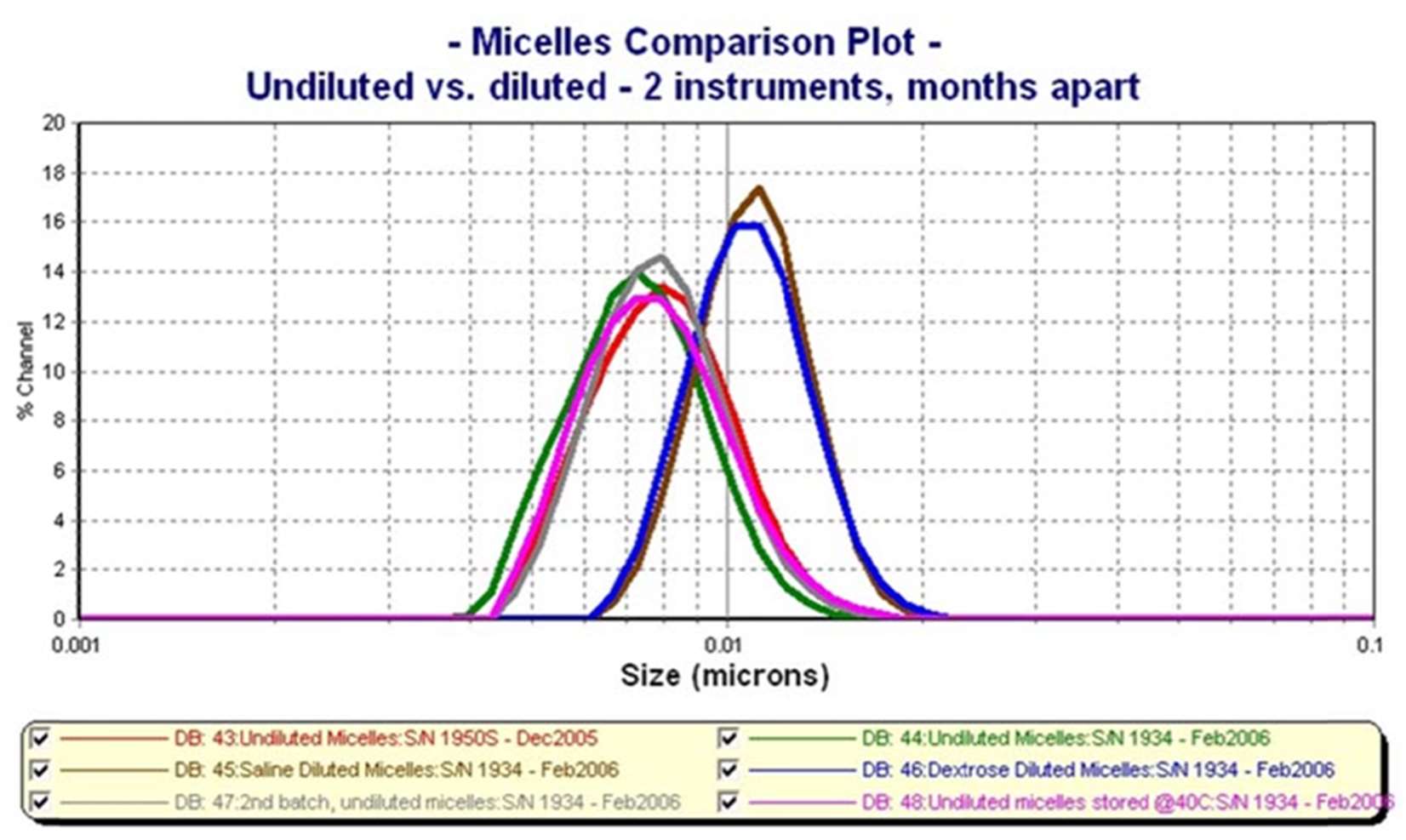
Nanotrac DLS產品線採用激光放大檢測和頻率功率譜計算克服了這些測量問題,激光放大檢測提供高達數百萬相對於 PCS技術的信噪比的倍數,頻率功率譜計算則無需事先了解尺寸分佈的形狀和形態,便可以自動選擇最佳估計算法。測量週期為 30 至 100 秒,和層析法比這大幅縮短了測量時間,最多可縮短 30至 360 分鐘,電泳程序或其他DLS儀器,而0.8 至 6500 nm 的測量範圍涵蓋了非常小的膠束、蛋白質的大小到較大的脂質體,濃度對於測量來說基本上是無關的(除非極度不透光樣品導致的多重光散射問題),因此無需使用其他可能改變微脂體成分並對測試產生影響的化學品來進行稀釋,下圖顯示的是使用 Nanotrac Wave II 在膠束上進行的穩定性實驗,顯示了用鹽水和葡萄糖稀釋會改變膠束的大小。
Nanotrac DLS產品線採用激光放大檢測和頻率功率譜計算克服了這些測量問題,激光放大檢測提供高達數百萬相對於 PCS技術的信噪比的倍數,頻率功率譜計算則無需事先了解尺寸分佈的形狀和形態,便可以自動選擇最佳估計算法。測量週期為 30 至 100 秒,和層析法比這大幅縮短了測量時間,最多可縮短 30至 360 分鐘,電泳程序或其他DLS儀器,而0.8 至 6500 nm 的測量範圍涵蓋了非常小的膠束、蛋白質的大小到較大的脂質體,濃度對於測量來說基本上是無關的(除非極度不透光樣品導致的多重光散射問題),因此無需使用其他可能改變微脂體成分並對測試產生影響的化學品來進行稀釋,下圖顯示的是使用 Nanotrac Wave II 在膠束上進行的穩定性實驗,顯示了用鹽水和葡萄糖稀釋會改變膠束的大小。
Nanotrac DLS功能:

- 獲得專利的激光放大檢測技術可實現最高信噪比且通過功率譜頻率計算真實粒徑分布
- 樣品無需高倍率稀釋或過濾,可測量高濃度樣品,濃度最高可測量固含量40%
- 簡單不複雜的操作界面,並且不需要使用者因應樣品選擇特定的粒徑計算方法
- 有機相或是水相樣品均能量測
- 具有不同機型或配件滿足不同測量需求

